Die Kryo-Elektronenmikroskopie hat im vergangenen Jahrzehnt eine regelrechte Revolution erfahren, da sie durch verschiedene Weiterentwicklungen die strukturelle Untersuchung von bisher mit anderen Methoden schlecht oder gar nicht zugänglichen Proteinkomplexen erlaubt. Diese rasante Verbesserung der Technik wurde 2017 mit dem Nobelpreis für Elektronenmikroskopie an Joachim Frank, Richard Henderson und Jaques Dubochet international anerkannt.
Die Kryo-EM-Messungen finden bei ca. -190°C statt, da so eine höhere Auflösung der Komplexe möglich ist als bei Raumtemperatur. Um die bisher ungeklärte molekulare Struktur der FDH aufzuklären, wurden mehrere Tausend elektronenmikroskopische Bilder des in vitrifiziertem, also glasklarem Eis eingebetteten Proteinkomplexes aufgenommen. Sodann wurde die Struktur mit computergestützter Bildverarbeitung dreidimensional rekonstruiert. Aus der Darstellung lässt sich ableiten, wie die beiden durch das Enzym katalysierten Teilreaktionen der Formiatoxidation und der Energiespeicherung über eine Elektronentransportkette miteinander verbunden sind. Dank dieser Information ist es möglich, das Enzym für industrielle Anwendungen zu optimieren. Um die Elektronenladung des Enzyms genauer zu untersuchen, wurden kryo-EM-Strukturen für zwei unterschiedliche Ladungszustände der FDH miteinander verglichen. Dabei konnte der Weg der Elektronen von einem Reaktionszentrum zum anderen genau nachvollzogen werden. Die Forscherinnen haben zum ersten Mal gezeigt, dass Kryo-Elektronenmikroskopie sehr gut dazu geeignet ist, Elektronentransferwege in Enzymen zu identifizieren und zu untersuchen.
Die neue Kryo-EM-Einrichtung befindet sich seit Anfang 2020 im Testbetrieb. Um das neue Gerät an der Universität Potsdam etablieren zu können, ist eine Co-Finanzierung des Landes Brandenburgs und der Deutschen Forschungsgemeinschaft (DFG) über 1,2 Millionen Euro eingeworben worden. An dem Antrag, der federführend von Prof. Dr. Petra Wendler gestellt wurde, waren insgesamt sieben Arbeitsgruppen des Instituts für Biochemie und Biologie der Universität Potsdam beteiligt. Das Mikroskop wird in den kommenden Jahren vor allem die Forschung in der Strukturbiologie, Biochemie, Enzymologie, Zellbiologie und Physiologie unterstützen.
Angaben zur Publikation:
Radon, C., Mittelstädt, G., Duffus, B.R. et al. Cryo-EM structures reveal intricate Fe-S cluster arrangement and charging in Rhodobacter capsulatus formate dehydrogenase. Nat Commun 11, 1912 (2020). https://doi.org/10.1038/s41467-020-15614-0
Abbildungen:
Foto: Das neue Thermo Fisher Talos F200 Elektronenmikroskop an der Universität Potsdam (UP/Wendler)
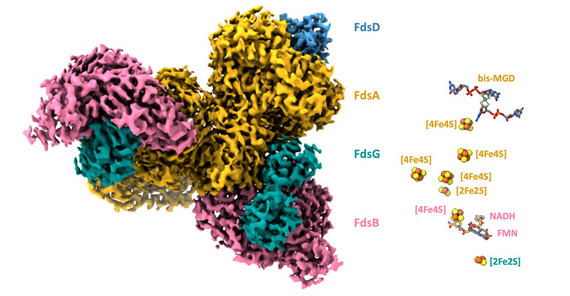
Grafik: Links: Kryo-EM-Struktur der FDH. Die vier Untereinheiten sind unterschiedlich eingefärbt. Rechts: Die Cofaktoren der FDH, farblich zu den Untereinheiten zugeordnet. (UP/Wendler)
Kontakt: Prof. Dr. Petra Wendler, Institut für Biochemie und Biologie, AG Biochemie
Telefon: +49 331 977 5131
E-Mail: pewendleruuni-potsdampde
Medieninformation 24-04-2020 / Nr. 049