Redoxproteine
Die Natur bietet eine Fülle von Enzymen, die die beiden Halbreaktionen einer Redoxreaktion über eine Elektronentransferkette verbinden. Biologische Prozesse wie Atmung, anaerober Stoffwechsel und Stickstofffixierung hängen von diesen Enzymen ab und bieten über Redoxproteine inspirierende Alternativen für schwierige chemische Umwandlungen.
Formiatdehydrogenase
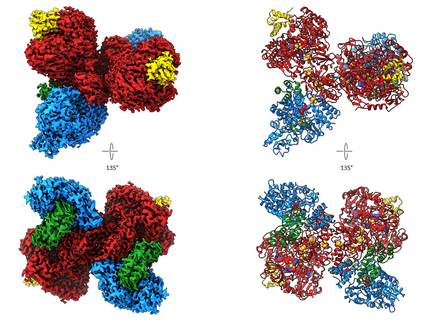
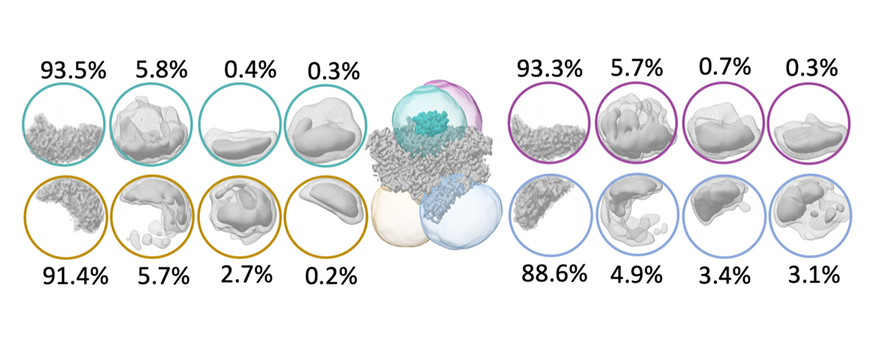
Im Jahr 2020 veröffentlichten wir die erste Kryo-EM-Struktur eines Molybdoenzyms, die Redox-Proteinformate Dehydrogenase aus Rhodobacter capsulatus (RcFDH). Dieses Enzym katalysiert die reversible Oxidation von Formaten zu Kohlendioxid und ist ein interessantes Ziel für biotechnologische Anwendungen wie Kohlenstoffbindung oder Wasserstoffspeicherung. Wir präsentierten die 3,3 Å-Kryo-EM-Strukturen von RcFDH unbehandelt und in Gegenwart von NADH. Die Strukturen zeigen eine komplexe Anordnung von Fe-S-Clustern im Dimer, einen konservierten Bindungsmodus des FdsD an die FdsA-Untereinheit und dass die NADH-Reduktion zur Aufladung elektronentragender Cofaktoren von RcFDH führt. Der gereinigte Komplex besteht aus vier Untereinheiten, FdsA, FdsB, FdsG und FdsD, und bildet ein 360 kDa-Dimer von FdsABGD-Heterotetrameren. Die Heterotetramere nehmen eine längliche Struktur mit Abmessungen von 140 × 80 × 77 Å an und sind im Dimer in einer nahezu senkrechten Rücken-an-Rücken-Orientierung angeordnet. Die Untereinheit FdsA enthält den Bismetall-bindenden Pterin-Guanin-Dinukleotid-Cofaktor, der das Molybdän bindet und das sauerstoffempfindliche aktive Zentrum erzeugt. Die durch Oxidation von Formiat gewonnenen Elektronen werden über eine 76 Å lange Elektronentransferkette, bestehend aus vier [4Fe-4S] Clustern und einem [2Fe-2S] Cluster, auf ein FMN und schließlich auf NAD+ übertragen. Die Elektronentransferketten in den Protomeren des Dimers sind durch zwei [4Fe-4S] Cluster verbunden, die sich an der Dimer-Grenzfläche befinden und einen Elektronenaustausch zwischen den beiden Protomeren ermöglichen. Wenn RcFDH mit NADH+ H+ reduziert wird, zeigen elektronentragende Cofaktoren ein Streuverhalten, das nur durch eine Ladungsänderung im Vergleich zum unbehandelten Enzym erklärt werden kann. Dies deutet darauf hin, dass vergleichende Kryo-EM verwendet werden kann, um Ladungsunterschiede in verschiedenen Zuständen von Redoxenzymen sichtbar zu machen.
Photosystem I
Das Photosystem I wandelt Sonnenenergie in elektrische Energie um, indem es den löslichen Redoxmediator Cytochrom c6 oxidiert und Ferredoxin reduziert. Um die transiente Bindung von Cytochrom c6 an das Photosystem I von Thermosynechoccus elongatus zu charakterisieren, wurde die Kryo-EM-Struktur des vernetzten Komplexes in Zusammenarbeit mit dem UniSysCat-Mitglied Athina Zouni von der Humboldt-Universität und Fred Lisdat von der TU Wildau mit einer Auflösung von 2,9 Å gelöst. Wir konnten zusätzliche Cofaktoren und Seitenkettendichten der Untereinheit PsaK identifizieren. Obwohl SANS-Daten auf eine komplexe Bildung zwischen TePSI und nicht nativem Cytochrom aus Pferdeherz hinweisen, konnten wir Cyt c6 in unserer Kryo-EM-Analyse aufgrund der schlechten Bindungsspezifität nicht identifizieren. Diese Ergebnisse zeigen die Schwierigkeit, sehr kleine Bindungspartner in Kryo-EM-Strukturen mit geringen Bindungsaffinitäten zu identifizieren.
Veröffentlichungen:
Radon C., Mittelstädt G., Duffus BR, Bürger J, Hartmann T., Mielke T, Teutloff C, Leimkühler S, Wendler P (2020) Cryo-EM structures reveal intricate Fe-S cluster arrangement and charging in Rhodobacter capsulatus formate dehydrogenase. Nat. Commun. 11:1912. doi: 10.1038/s41467-020-15614-0
Kölsch A., C. Radon, M. Golub, A. Baumert, J. Bürger, T. Mielke, F. Lisdat, A. Feoktystov, J. Pieper, A. Zouni, P. Wendler (2020) Current limits of structural biology: The transient interaction between cytochrome c6 and photosystem I. Cur Res in Struc Biol 2:171-179. doi: 10.1016/ j.crstbi.2020.08.003